東京大学教養学部化学部寄稿連載「東大入試から学ぶ化学」
(寄稿=東京大学教養学部化学部)
こんにちは!東京大学教養学部所属の田中健太と申します。今回の記事は前回の続きとなります。「前回の記事を見ていないよ〜」と言う方は先にそちらを閲覧いただけると幸いです(^^)/
前回記事はこちら
さて、今回のテーマはついに「ヨードホルム反応〈実践編〉」ということで反応を1段階ずつ丁寧に追っていきたいと思います。楽しみですね!まずは実際の入試問題を見ていきましょう。
【問題】2020年第1問Ⅱより抜粋
水中でアセトンに過剰量の水酸化ナトリウムとヨウ素を反応させると,特有の臭気を有する黄色の化合物Iが沈殿し,反応液中に酢酸ナトリウムが検出された。
問キ 化合物Iの分子式を示せ。
【解答】
CHI3
(解答は東京大学教養学部化学部が作成)
【考察】
§1 ヨードホルム反応陽性の部分構造
本題に入る前にヨードホルム反応を起こす物質を確認しておきましょう!代表的なものはエタノールや、今回の問題でも出てきたアセトンでしょう。もっと一般的に言うと、ヨードホルム反応陽性の物質は皆、アセチル基もしくは酸化するとアセチル基になる部分構造を持っています。ちなみにアセチル基はこんな↓官能基です。
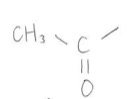
§2 ヨウ素の酸化力
塩基性条件下にてヨウ素は酸化力を持つことをみなさんご存知でしょうか?
前セクションでヨードホルム陽性であるのはアセチル基もしくは酸化するとアセチル基になる部分構造と申し上げましたが、どうしてこんなまどろっこしい言い方になっているかと言いますと、ヨウ素に酸化力があるからなのです!つまり元の化学物質はアセチル基を持っていなくても、ヨウ素の助けでアセチル基を作ることができれば、ヨードホルム反応を起こすことができるのです。
では何故塩基性条件下でヨウ素は物を酸化することができるのでしょうか。ここではエタノールを反応物質の例にとって解説したいと思います。
〈2-1 I2と、OH–の反応〉
まずはI2と、OH–の反応について考えてみます。I2の構造はとっても簡単で、2つのI原子が一組の電子対を共有してつながった構造をしています。これとのどことどこが反応するかを考えることになりますが……
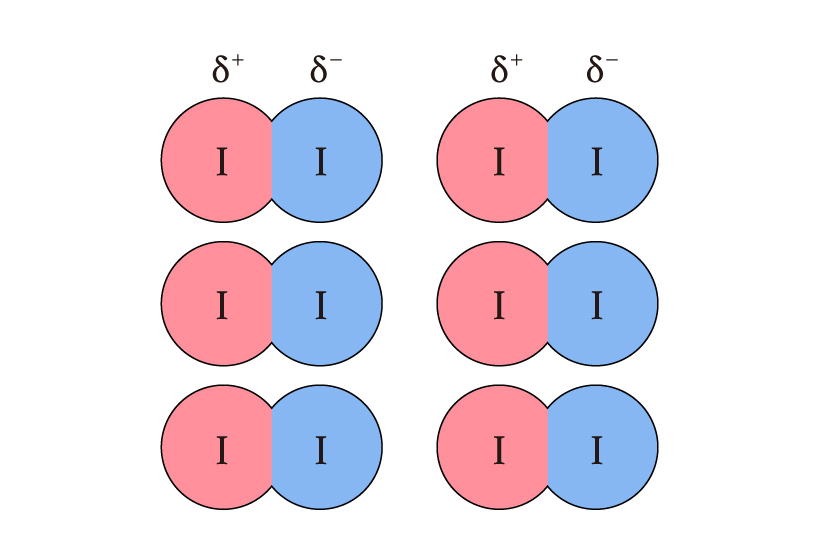
まずはOH–全体として電気的に陰性です。そしてどの部分が陰性かと言いますと酸素の部分です。何故なら酸素の方が水素よりも電気陰性度が大きく、尚且つ酸素の周りにはたくさんの電子があるからです。下図のOH–のルイス構造式を参考にしてください。
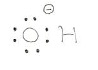
そしてI2はどうかと言いますと、まず全体としては電気的に中性です。そして極性があるかというと、どちらも同じI原子同士なので極性もないですね。ということは電気的に陽性な部分がないので、OH–と引き合う部分がなく、反応が進まなそうに思えます。
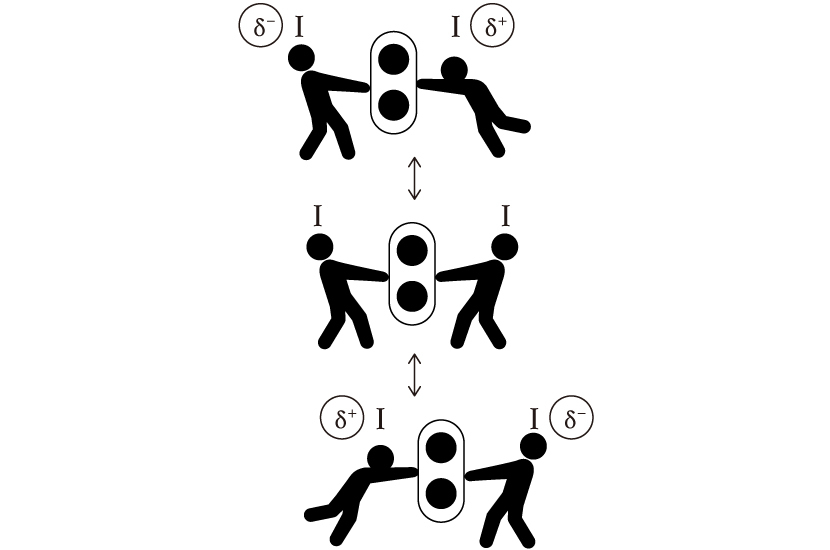
しかしながら、実はI2にも電気的に陽性な部分があります。もっと正確にいうと、陽性な箇所が現れたり消えたりするという言い回しになるかと思います。
どういうことかと言いますと、まずI2というのはI原子同士が共有電子対を引っ張りあっている構造をしています。しかしお互いの電気陰性度、電子の欲しさは同じなので、引っ張る力が均衡して互角の綱引き勝負をしています。
では共有電子対はずっと二つのI原子の間にあるかというとそんなことはありません。下図のように、ある時は右側にある時は左側に寄り、結果として電荷分布の揺らぎが生じます。これによって電気的に陽性な部分が一時的に生じ、そこへがOH–アタックする、という仕組みなのです!
〈補足〉「I原子が綱引きっていうけれど原子の世界に運動会なんてないでしょ!」と思われた読者様もいらっしゃると思うのでもう少し堅めに解説したいと思います。この例えは次のように例えることもできます。二つの壁の間にバネ、鉄球、バネの順で直列にこれらを配置します。バネの片方は壁につながっていて、もう片方は鉄球につながっています。ちょうど下図のような状況です。
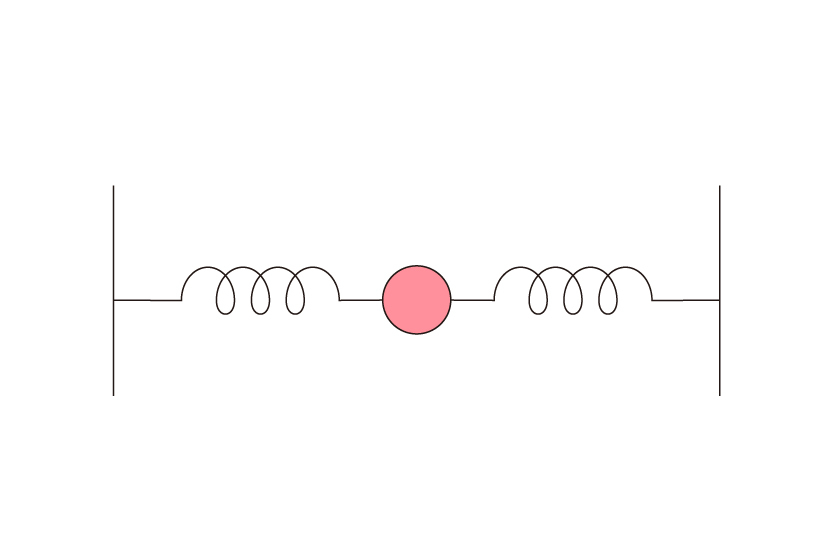
二つのバネは全く同じ材質、同じ長さだとして、上の状況において伸びているとします。すると、鉄球はちょうど壁と壁との真ん中の位置で停止し続けるでしょう。しかし、一度外から力が加えられると右に左に振動し始め、エネルギー減衰などがない限りは永久に振動し続けます。
これと同じことが実際の分子でも起きています。その証拠にヨウ素には固体があります。固体は分子同士が集まっている状態ですので分子間で引力が働いているとも言えます。ヨウ素の場合、この引力の由来は何でしょうか。一つに考えられうるのは万有引力です。しかしながら万有引力程度の弱い力では固体の状態を保つことはできません。実際にはクーロン力の寄与が大きいとされています。ヨウ素分子のどの部分も電気的に中性だったら、クーロン力なんて働かないはずです。つまり電荷分布の揺らぎがあるからこそ電気的な引力が分子間で働き、その結果固体の状態を保つことができるのです!ちなみにこの力をロンドン力と呼びます。
(補足終わり)
長くなりましたがI2とOH–の反応をみていきましょう!
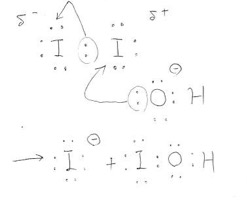
上図を見てください。ここで矢印は電子対の動きを表します。電子二つセットで動くことに注意してください。まず電気的に陰性なO原子が、右のI原子にアタックします。すると右のI原子は左のI原子と手を切って、O原子と新たに手を結びます。その際、ヨウ素同士で共有していた電子対は左のI原子に渡り、左のI原子はI–として脱離していきます。
このように例えるとわかりやすいかもしれません。ヨウ素の間には子供(共有電子対)がいましたが、酸素の熱烈なアタックに負けて、右のヨウ素は酸素とくっつくようになりました。左のヨウ素は泣く泣く子供を連れてヨウ化物イオンとして去っていきました……なんだか悲しい話になってしまいましたね。

さて、お次の段階です。生成したIOH;次亜ヨウ素酸とOH–がさらに反応します。こちらは簡単です。名前からもわかるようにIOHはH+を放出します。それ故このような反応が起こります。
IOH+OH–→IO–+H2O
ここで突然のクイズです。IOH;次亜ヨウ素酸は何故酸として機能するのでしょうか。是非立ち止まって考えてみてください。
私なら「IもOも電子が好きだから」と答えますかね!二つの原子はどちらも電気陰性度の値が大きいです。つまり電子を吸い寄せる性質があるということです。それ故Hは電子を奪われてH+になります。そう考えてみると、酸と呼ばれる物質はほとんど“電子が好きな原子”と”H原子”の組み合わせではないでしょうか。HF、HCl、HBr、H2S、H2SO4などなど……
最後にI2とOH–の反応を一つの式でまとめるとこうなります。
I2+2OH–→IO–+H2O+I–
〈2-2 エタノールの酸化〉
次にエタノールが酸化される機構を考えてみましょう。
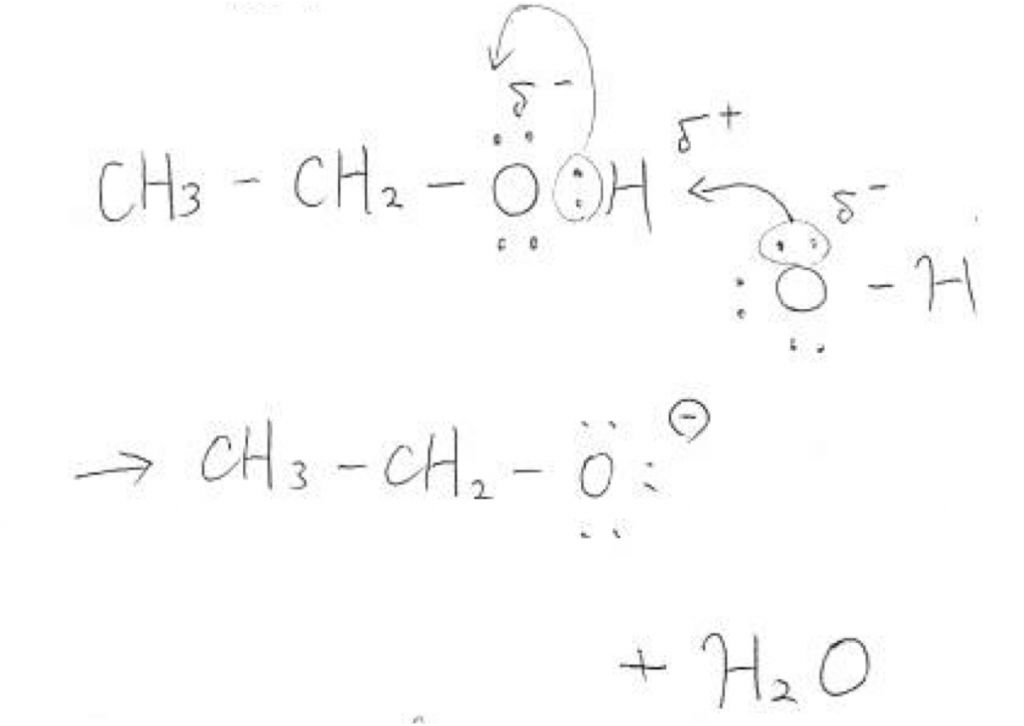
まずエタノールの電気的に陰性な箇所はどこでしょうか。ずばりOの部分ですね。理由はもちろんOが電子が好きだからです。ということはOに結合しているHは電子を奪られかけているので電気的に陽性です。ここにOH–がアタックします。そしてHはのOとくっつくこととなり、エトキシドイオンとH2Oが生成します。
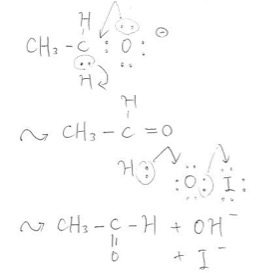
エトキシドイオンのOからは一つの価標(以下「棒」と略記します)が伸びていますが、多くの化学物質においてOからは二つの棒が伸びています。水や酸素分子、エーテルなどが例です。そう考えると二つ棒が伸びていた方が安定なことが多いと推察できるかと思います。
というわけで、エトキシドイオンのOも棒を二本伸ばしたいと思っているはずです。案の定Oは隣のCとさらにもう一本結合を作ります。その際CはOと新たに二重結合を結ぶ代わりにH一つと手を切ります。HはかつてCと共有していた電子対を連れて去って行きます。
それを見ていたIO–のOはHと手を結びたくなり、Iと手を切ります。この際、共有電子対はIの手に渡りとして脱離します。そしてHとOは出会い、OH–が生成します。
以上がエタノールとIO–との反応でした。一連の反応を一つの式にまとめると次のようになります!
CH3CH2OH+IO–→CH3CHO+H2O+I–
〈補足〉わかりやすさのために段階的に説明申し上げましたが、実際のアセトアルデヒドの生成は一連の反応が流れるように同時に起こり、進行していきます。
§3 アセチル基を持つ物質が起こすヨードホルム反応
ここからがようやく本番です!ラスボス討伐前にここで一息コーヒーブレイクというのもいいかもしれません(^^)/ ちなみに私は東大受験本番にラムネとコーヒーを持参して臨みました。甘いものを食べてコーヒーを飲むとなんだか頭が冴える気がします。気のせいかもしれませんが!定期試験の時もコーヒーは欠かさず飲んでいますね〜
ではでは、いよいよこれまでご紹介した考えを用いてヨードホルム反応を攻略していきましょう!今回はアセトンを例に用います。問題文を読みますと過剰量の水酸化ナトリウムとありますから、アセトンの周りには大量の水酸化物イオンがあります。よってアセトンと水酸化物イオンが最初に反応しそうだなと目星をつけることができます。
アセトンの電気的に陽性な部分はどこか考えてみましょう!
Oと二重結合しているCではないかと思った読者様は大変鋭いです!実際そのCとOH–が反応したらこのようになります。
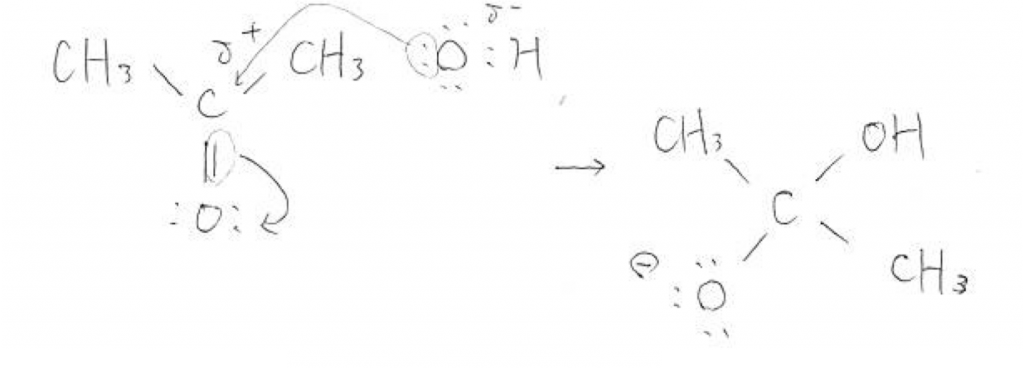
ビリヤードのように電子対が押し出され、上図のような四面体のイオンが生成することでしょう。もちろんこの反応も起こると考えられますが、次の一手が指せず詰んでしまうので別の反応経路を考えることになります。
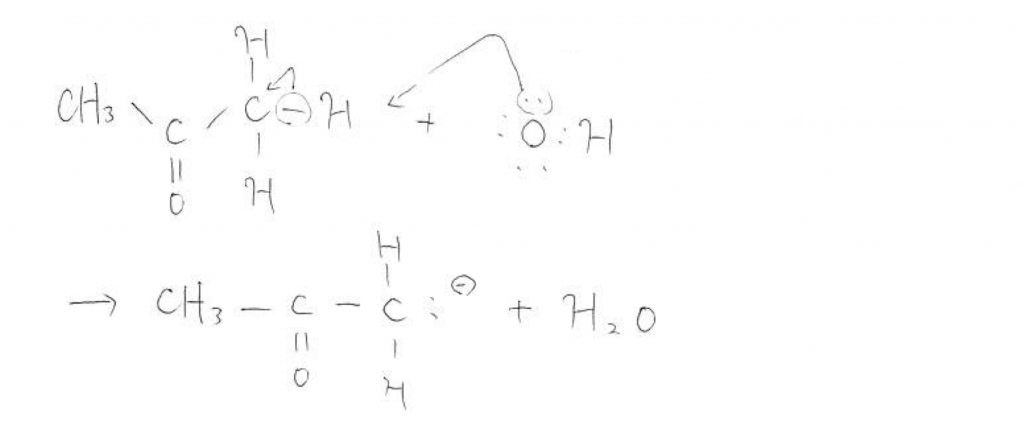
そこでOH–は上図のように端っこのメチル基のHをさらって行きます。すると端っこの炭素は負の電荷を帯びることとなります。炭素は電子が好きでもなければ嫌いでもないという原子です。それ故一見生成したこの陰イオンは不安定に思えます。
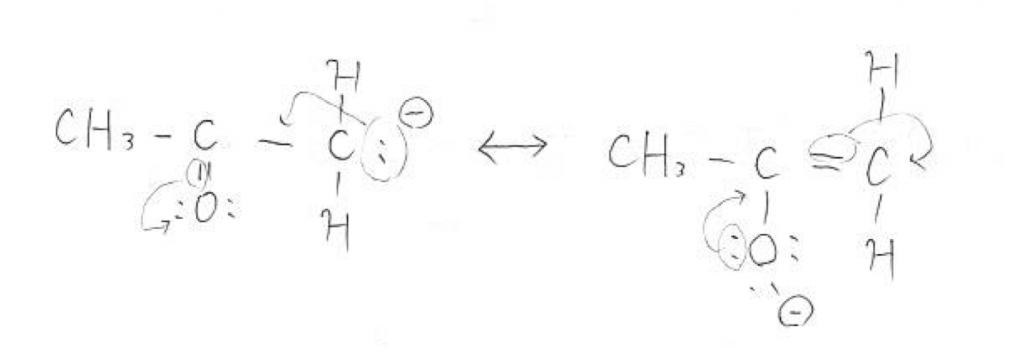
しかし、生成した陰イオンは上図のように共鳴しています。それ故電子が非局在化し、安定に存在することができるのです!ちなみに右の陰イオンはエノラートイオンという名前の化学種です。
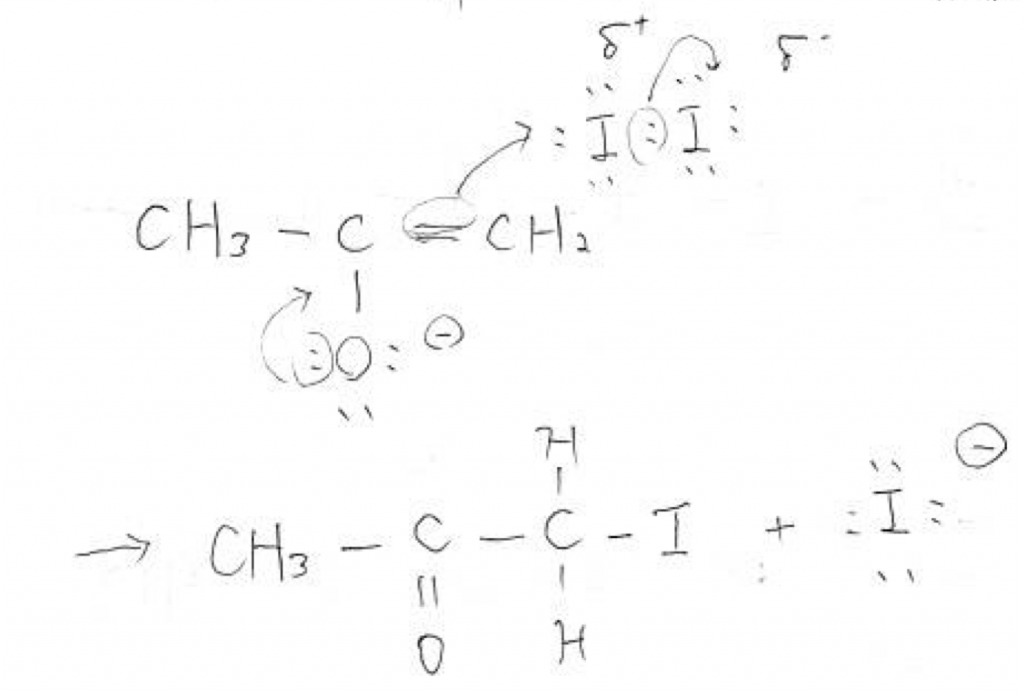
上図のようにエノラートイオンの二重結合の豊富な電子に誘われて、I2がやってきます。そして左のI原子は右のI原子と手を切り、エノラートイオンと新たに手を結びます。そうしてアセトンの一つの水素がヨウ素に置き換わった物質ができます。
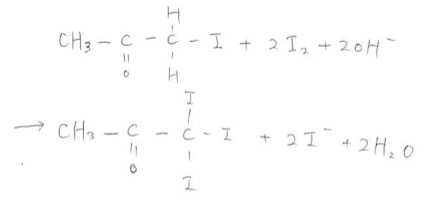
同様の反応が繰り返されてアセトンの右側の水素が三つともヨウ素に置き換わった物質ができます。
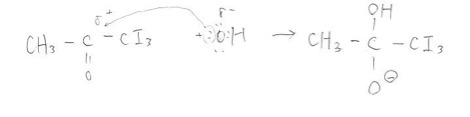
そして最後にアセトンのOと二重結合をしているCにOH–がアタックして上記のような四面体のイオンができます。
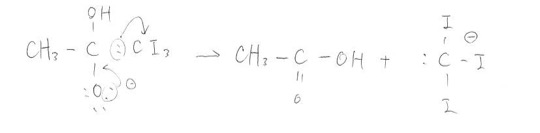
そこからが脱離して酢酸が生成します。
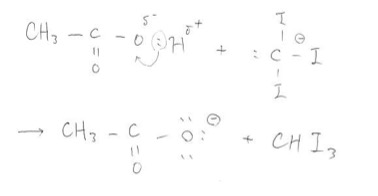
最後に酢酸とCl3–が反応して酢酸イオンとCHI3が完成するのです!
一連の反応を一つの式でまとめるとこうなります。
CH3COCH3+3I2+4NaOH→CH3COONa+CHI3+3NaI+3H2O
アセトンの一つの水素をヨウ素化するのに、一つのI2と一つのOH–を使うのでI2の係数は3とすぐにわかります。そしてはOH–最後にCI3–を脱離させたときに追加で一つ用いたのでNaOHの係数は3+1で4となります。後は適当に数が合うように右辺の係数を書けば完成です!
ちなみに2011年度の東大入試化学ではヨードホルム反応の化学式が求められましたが、ヨードホルム反応の反応機構を知っていればこのようにスッと書けてしまいます!
今回の記事はいかがでしたでしょうか。ここまで読んでくださり大変ありがとうございました!ほぼ一問一答のような出題形式が多いヨードホルム反応ですが、掘り下げてみるとこんなにも面白いのです!解説を書くにあたり、私としても色々と勉強させて頂き大変ありがたいご縁となりました。私のこの記事が皆様の楽しい化学ライフの一助となれば幸いです。それではまたの機会にお会いできることを楽しみにしております(^^)/
【連載 東京大学教養学部化学部寄稿 東大入試から学ぶ化学】
【東京大学教養学部化学部寄稿】東大入試から学ぶ化学② ヨードホルム反応〈基礎編〉~有機反応の理解に役立つ化学の基礎知識~












